北京時間12月13日,我校藥學院藥理系、重慶中國藥科大學創新研究院、多靶標天然藥物全國重點實驗室肖易倍教授,藥學院藥理系陳美容副教授,生命科學與技術學院陸美玲副教授合作在Science雜志上以“First Release”形式在線發表了題為Antiviral signaling of a type III CRISPR-associated deaminase的研究論文。肖易倍教授、陳美容副教授、陸美玲副教授為該論文的通訊作者。藥學院博士研究生李鈺濤、博士后李兆星,藥學院碩士研究生閆樸睿、孔健平,以及生命科學與技術學院碩士研究生華晨揚為該論文的共同第一作者。中國藥科大學為該論文的唯一通訊單位。
CRISPR-Cas系統是原核生物中廣泛存在的一種由RNA引導靶向外源遺傳物質的核酸免疫系統。基于II型CRISPR-Cas9的基因編輯技術,獲得2020年諾貝爾化學獎,并在生物醫藥等諸多領域產生了革命性的影響。而III型CRISPR-Cas系統是目前發現的所有CRISPR-Cas系統中最復雜的一類系統,闡明其作用機制具有重要的科學意義和潛在的應用價值。不同于其余Cas系統直接靶向并切割外源核酸,III型CRISPR-Cas系統識別外源核酸后會合成第二信使環化腺苷(cAn)來激活下游效應核酸酶的非特異性切割活性,從而實現免疫。但該團隊前期通過生物信息學分析挖掘到一類III型CRISPR-Cas下游缺失了廣泛分布的核酸酶模塊,取而代之的是一個融合了第二信使識別結構域的脫氨酶CAAD,以及一個可能降解核苷的水解酶Nudix。表明該類系統的作用機制可能完全不同于已知的通過切割核酸實現免疫的CRISPR-Cas系統。鑒于合成環化核苷酸第二信使和腺苷脫氨分別在人源核酸免疫系統cGAS-STING和ADAR中存在,該團隊大膽推測這類系統很可能是通過核苷酸代謝來實現其免疫效應。為了證明這一假設,團隊成員通過體外重組,首先證明該系統效應復合物Cmr識別外源核酸后會利用ATP為底物合成cA3/cA4/cA6三種環化腺苷。其中cA4和cA6可做為第二信使特異性激活CAAD的脫氨酶活性,將ATP轉變成ITP, 迅速導致ATP耗竭從而抑制被感染細菌的生長。但ITP的蓄積往往會導致較強的細胞毒性,團隊進一步證明了水解酶Nudix可特異性地將ITP降解成IMP,并通過這一解毒效應恢復細菌生長。為了闡明cA4/cA6如何激動CAAD并將ATP脫氨生成ITP的分子機制,團隊利用冷凍電鏡捕捉到了CAAD從無活性到被激活過程中一系列的高分辨率三維結構,直接觀察到并證實了其激活過程中存在協同效應。該項研究發現了核酸免疫系統中一條全新的核苷代謝-免疫調控-抗病毒通路,并闡明了其具體的分子機制,為開發III型CRISPR系統作為應用工具打下重要的理論基礎。
近三年,團隊成員聚焦核酸免疫與調控,以通訊作者(含共同通訊作者)在Science、Nature Chemical Biology、Cell Research、Nature Communications、PNAS、NAR、Cell Reports、APSB和JMC等學科頂尖及以上期刊發表研究論文近30篇,申報專利50余項。在本課題開展過程中,團隊積極依托學校有組織科研體系,通過與生命科學與技術學院陳依軍教授、藥學院藥物化學系楊鵬教授、藥物分析系紀順利副教授、中藥學院趙玉成教授、湖南中醫藥大學李順祥教授、新加坡國立大學胡純一教授、南京財經大學李光磊博士等團隊聯合攻關,最終得以順利完成本課題。生命科學與技術學院碩士研究生吳宛倩和崔鈺瑢,湖南中醫藥大學博士研究生段彥亦參與了本課題研究。
該研究工作得到了國家自然科學基金創新研究群體項目(82321005)、國家重點研發計劃(2023YFC3402300)、江蘇高校優勢學科建設工程第四期(1132210017)等項目的支持。上海交通大學分析測試中心和南方科技大學冷凍電鏡平臺為數據采集提供了重要支撐。
全文鏈接:https://www.science.org/doi/10.1126/science.adr0393
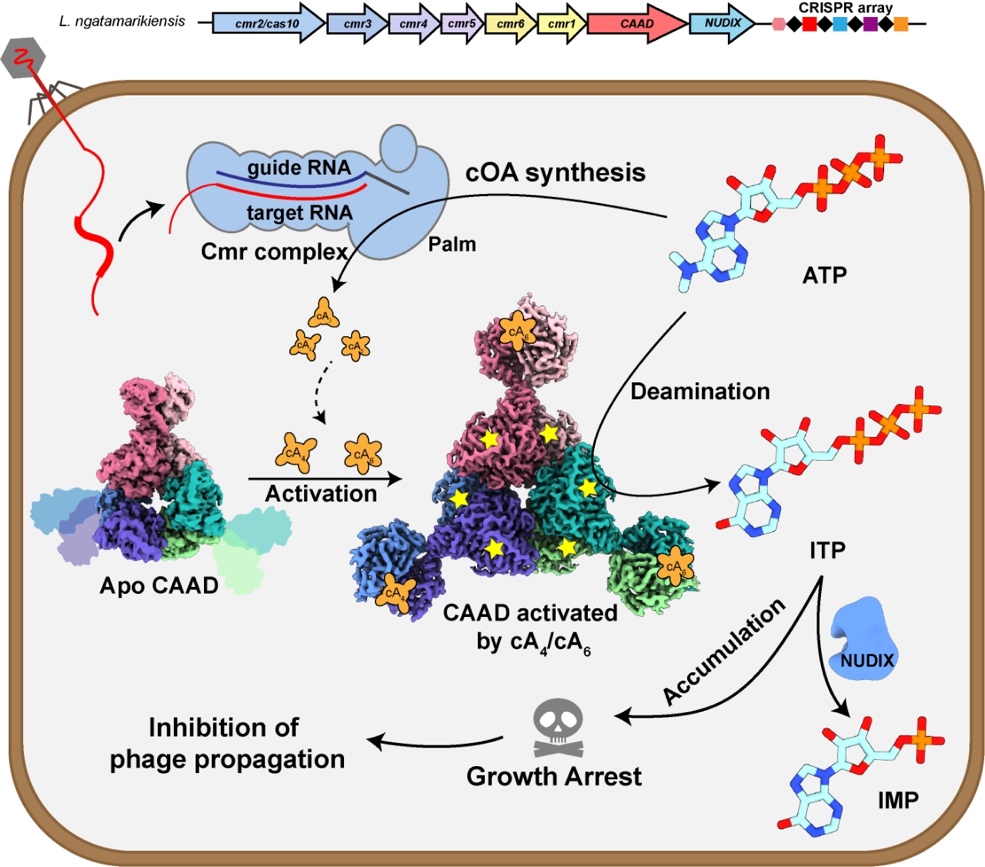
示意圖
(供稿單位:藥學院、生命科學與技術學院,撰寫人:肖星宇,審稿人:劉帆、鄭詩翌)

